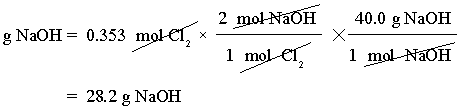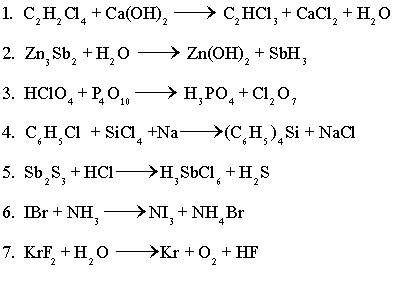ตัวอย่างสมการเคมี
สมการเคมีโดยทั่วไปแล้วจะใช้สัญลักษณ์แทนของธาตุต่าง ๆ มีลูกศรที่ชี้จากด้านซ้ายของสมการไปทางด้านขวาเพื่อบ่งบอกว่าสารตั้งต้น(reactant)ทางด้านซ้ายมือ ทำปฏิกิริยาเกิดสารใหม่ขึ้นมาเรียกว่าผลิตภัณฑ์ (product)ทางด้านขวามือ ดังนั้น จากสมการเคมีเราสามารถใช้คำนวณหาได้ว่าใช้สารตั้งต้นเท่าไรแล้วจะได้ผลิตภัณฑ์ออกมาเท่าไร
จากกฎทรงมวลเราจึงต้องทำให้แต่ละข้างของสมการต้องมีจำนวนอะตอม และประจุที่เท่ากัน เรียกว่า การดุลสมการ ซึ่งมีข้อสังเกตดังนี้
1. พยายามดุลธาตุที่เหมือนกันให้มีจำนวนอะตอมทั้งสองด้านเท่ากันก่อน
2. ในบางปฏิกิริยามีกลุ่มอะตอมให้ดุลเป็นกลุ่ม
3. ใช้สัมประสิทธิ์(ตัวเลขที่ใช้วางไว้หน้าอะตอม)ช่วยในการดุลสมการ แล้วนับจำนวนอะตอมแต่ละข้างให้เท่ากัน
2. ในบางปฏิกิริยามีกลุ่มอะตอมให้ดุลเป็นกลุ่ม
3. ใช้สัมประสิทธิ์(ตัวเลขที่ใช้วางไว้หน้าอะตอม)ช่วยในการดุลสมการ แล้วนับจำนวนอะตอมแต่ละข้างให้เท่ากัน
ตัวอย่างที่ 1 ให้ทรงกลมสีแดง แทนอะตอมของออกซิเจน และทรงกลมสีน้ำเงินแทนอะตอมของไนโตรเจน รูปใดแสดงถึงผลิตภัณฑ์จากปฏิกิริยานี้
แนวคิด ดูจากผลิตภัณฑ์ที่ได้คือ NO2 โดยมี N 1 อะตอม กับ O 2 อะตอม คำตอบคือข้อ ค.
ตัวอย่างที่ 2 จงดุลสมการต่อไปนี้
แนวคิด จากสมการ ให้ดุล Fe ก่อน ซึ่งด้านซ้ายมี 1 อะตอม ด้านขวามี 2 อะตอม ดังนั้นต้องใส่สัมประสิทธิ์ด้านซ้ายเป็น 2
ดุล O2 ด้วย สัมประสิทธิ์ 3/2
ทำให้เป็นเลขจำนวนเต็มโดยการ x 2 ทั้งสมการ
จะได้สมการสุดท้ายคือ
ตัวอย่างที่ 3 จงดุลสมการต่อไปนี้
ในสมการเคมีสามารถบอกอัตราส่วนแสดงจำนวนอะตอมหรือโมเลกุลของสาร ซึ่งเทียบได้โดยตรงกับจำนวนโมลที่ใช้
ในการคำนวณมีขั้นตอน ดังนี้
1. เขียนและดุลสมการเคมี (สัมประสิทธิ์หน้าสมการเคมีที่ดุลแล้วทำให้ทราบอัตราส่วนโดยโมลของสารที่ทำปฏิกิริยาพอดีกัน)
2. จากโจทย์ อาจกำหนดปริมาณของสารในหน่วยต่างๆ เช่น มวล หรือ ปริมาตร ดังนั้นต้องเปลี่ยนให้เป็นหน่วยโมล
3. นำจำนวนโมลของสารที่ได้ในข้อ 2 ไปคำนวณ เพื่อหาปริมาณของสารตามที่โจทย์ต้องการ โดยเทียบกับอัตราส่วนโดยโมลของสารที่ได้จากข้อ 1
ความสัมพันธ์ของสมการเคมีกับการคำนวณ
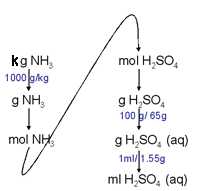
ตัวอย่างที่ 4 แอมโมเนียมซัลเฟต (NH4)2SO4 ใช้เป็นวัตถุดิบผลิตปุ๋ย เตรียมได้โดยการผ่านแก๊สแอมโมเนีย (NH3) ลงในสารละลาย 65% ของกรดซัลฟิวริกที่มีความหนาแน่น 1.55 g/mL ต้องใช้กรดซัลฟิวริก (H2SO4) ปริมาตรเท่าไรในการทำปฏิกิริยากับ 1.00 กิโลกรัมของแก๊สแอมโมเนีย เพื่อให้เกิดปฏิกิริยาพอดี
แนวคิด ต้องเขียนสมการเคมีก่อน และดุลสมการด้วย
วิธีคิด
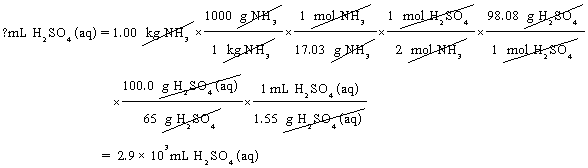
ดังนั้น ต้องใช้สารละลายกรดซัลฟูริก 2.9 ลิตรในการทำปฏิกิริยา
ตัวอย่างที่ 5 สารละลาย Sodium hypochlorite (NaOCl) หรือที่รู้จักกันคือน้ำยาซักผ้าขาว เตรียมได้จากปฏิกิริยาระหว่าง Sodium hydroxide กับ Chlorine
ต้องใช้ NaOH กี่กรัมในการทำปฏิกิริยากับ 25.0 g Cl2
แนวคิด ดุลสมการเคมีก่อนอันดับแรก จากนั้นดูว่ามีค่าใดที่กำหนดมาให้บ้าง แล้วทำตามแผนดังนี้
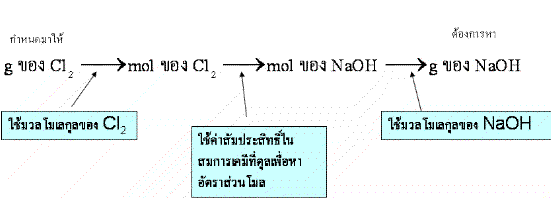
เริ่มต้นจากการหาจำนวนโมลของ Cl2 โดยมวลโมเลกุลของ Cl2เท่ากับ 70.9 g/mol ดังสมการ
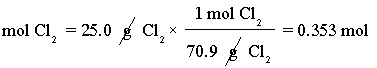
จากสมการเคมีจะได้ว่า 1 โมลของ Cl2 ทำปฏิกิริยากับ 2 โมลของ NaOH และมวลโมเลกุลของ NaOH คือ 40.0 g/mol จะคำนวณหาจำนวนกรัมของ NaOH ที่ต้องใช้ทำปฏิกิริยา ดังสมการ